

バイオシミラーの振興と発展に寄与することで、医療の発展に貢献することを目的として2016年4月に「日本バイオシミラー協議会」は発足しました。まずは医療関係者の皆様のバイオシミラーに対する認知度を高め、理解を深めていただきたいと考え、「バイオシミラーが患者さんと社会にもたらすメリットとは?」をテーマに対談を企画しました。 当協議会の黒川達夫理事長との対談にお招きしたのは、『日本ジェネリック医薬品・バイオシミラー学会』代表理事の武藤正樹先生。バイオシミラーはなぜ必要なのか、そして、バイオシミラーの現状から普及に向けた課題、将来像までを話し合っていただきました。(対談日:2017年9月13日)
1. バイオシミラーとは
バイオシミラーは、先行バイオ医薬品と同等/同質の医薬品である
2015年以降、バイオ医薬品(バイオテクノロジー応用医薬品)が続々と特許切れを迎えています。しかしながら、そのバイオ医薬品のジェネリックとも言えるバイオシミラー(バイオ後続品)の認知度は、医療関係者においても必ずしも高くないのが現状です。まずはバイオシミラーとは何か、バイオ医薬品とバイオシミラーの違いから伺って参りたいと存じます。
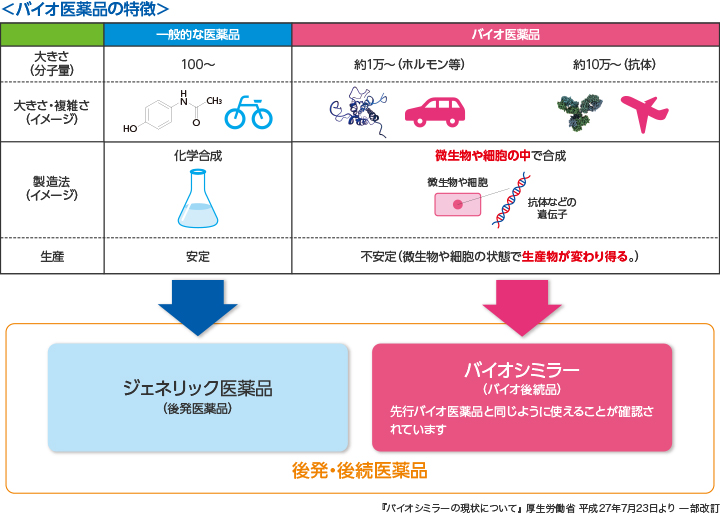
武藤 バイオシミラーの前にまずバイオ医薬品について説明しますと、バイオ医薬品とはタンパク質を構成成分とする医薬品で、細胞、酵母、細菌などの生物によって産生される医薬品です。遺伝子組み換え技術や細胞培養の技術を応用し、動物または微生物が持つタンパク質を作る能力を利用して製造されるのです。いわば細胞という工場の中で薬を作ってもらうイメージですね。従来の有機合成、化学合成で作る低分子の医薬品とは全く製造過程が異なります。1980年代より開発が進められており、主に酵母や大腸菌、動物細胞、さらに最近ではカイコといった昆虫まで使い、ホルモン、酵素、モノクローナル抗体といったタンパク質の産生を行っています。バイオ医薬品の治療効果としては、がんや血液疾患、自己免疫疾患等多くの難治性疾患に卓抜した治療効果が得られることが確認されています。
黒川 一方、後続品であるバイオシミラーは今、武藤先生のお話にありました先行バイオ医薬品(以下先行品)と比べ、基本的な性質を決めるアミノ酸配列は全く同一ですが、それを作り出す方法――例えば、用いる細胞株や培養工程――が異なります。製造業者が独自の方法で行うからです。そのため、糖鎖や不純物の割合なども含め、先行品と必ずしも完全に同一のものではありません。しかしながら品質試験、薬理作用を確かめる試験、毒性に関する試験、臨床試験などによって同等性/同質性が検証され、実際に医療の第一線で同等に使用され得る医薬品として提供されています。
そもそもバイオ医薬品自体、全く同一の製品を作ることはできないと言われていますね。
黒川 そうです。バイオ医薬品は生きた動物細胞や酵母などを用いるため、全く同一のものを作ることは不可能で、ロットごとに糖鎖の種類や割合、不純物の割合などが少しずつ異なります。今の優れた分析化学でも、糖鎖の種類や配列などを厳密に決めることはなかなか困難だという事情もあります。
バイオシミラーも同様に、全く同じものは作れませんが、それがすなわち「違うもの」というわけではありません。多くの試験により、厚生労働省から出された『バイオ後続品の品質・安全性・有効性確保のための指針』(以下ガイドライン)に基づく同等性/同質性の検証が行われ、臨床上、十分安心して活用できる製品と認められています。
武藤 ガイドラインではバイオシミラーを「国内で既に新有効成分含有医薬品として承認された先行品と同等で同質の品質、安全性および有効性を有する医薬品として、異なる製造販売業者により開発される医薬品である」と定義しています。
黒川 非常に的確な定義だと思います。シミラーという英語は、「似ている・同じではない」と訳されていますが、欧米での概念としては「almost the same、ほとんど同じ」という意味です。繰り返しになりますが、バイオシミラーは物理化学的にみると糖鎖の位置や不純物の構成が対照となる先行品と若干の違いはあるものの、厚生労働省の基準等を満たしており、臨床の第一線では先行品と同等の安全性と有効性があるということです。
武藤 検出方法の問題などもあり、先行品とバイオシミラーの有効成分の「同一性」を実証するのは困難です。しかしながら品質特性において類似性が高く、かつ品質特性に何らかの差異があったとしても最終製品の安全性・有効性に有害な影響をもたらさない、という条件下において「同等」「同質」と言えると私も理解しています。臨床的には問題なく使用できます。
化学合成する低分子のジェネリック医薬品の場合は、有効成分が分子的にも明らかに同じであることが承認申請の条件になっていますが、バイオシミラーの場合は、目的物質が完全に同一であることは要求されていません。ここがジェネリック医薬品との違いですね。
黒川 そうですね。目的物質が完全に同一であることは要求されておりませんし、仮に要求されたとしても、同一性を証明することは現在の最新科学をもってしてもできません。品質特性の確認すら難しい。しかし、バイオシミラーは先行品と同様、臨床上インパクトのある治療法ですので、そうした有用な治療法への医療アクセスを改善し、治療の質の向上と患者の経済的負担の軽減や医療費の削減に貢献することが期待されていることは、間違いありません。
最新の知見により、品質・安全性・有効性が確保されている
バイオシミラーの医薬品としての評価方法はどのようになっているのでしょうか。
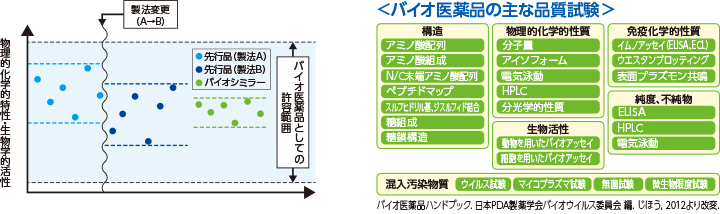
黒川 医薬品には、当然、一定の効力があるものを医師・患者さんへ繰り返し安定的に供給することが求められます。当たりはずれがあっては困るわけです。低分子の医薬品は物理化学的な性質を担保することにより一定の効力のある医薬品を供給することができます。ところがバイオ医薬品の分子構造は複雑で多様です。分子量が約1万から数十万前後まであり、コントロールが難しいのです。その条件下でどうやって同じ効力を持つ医薬品を安定的に同じ効力を持って提供するか、という観点で試験項目や品質管理に関する試験項目が規定されています。
バイオシミラーにおいても、例えばアミノ酸の配列を決めるDNAのコドンやアミノ酸の一次シークエンスは、先行品と同じでなければなりません。糖鎖についてはその有無によってどれだけ違いが出るのかを薬理試験で調べます。産生された無数のバイオ医薬品分子は一つひとつが完全に一致するわけではありませんから、フィルターにかけ、できるだけ同一のものに純化します。その繰り返しの中で、先行品と同等/同質のものを作るノウハウを積み上げ、先行品と同じ治験データが確立できたとき、厚生労働大臣の医薬品の製造販売の許可を得るということになります。
また、バイオシミラーの製法開発に当たっては先行品の承認時からかなりの期間を経ており、その時点での最新の安全対策等が可能な場合にはそれを積極的に採用することが可能です。実際のところ、測定感度は10年前に比べて格段に上がっています。
武藤 私は実際に大学病院で、あるバイオシミラーの臨床試験を行ったことがあります。臨床結果は先行品と同じで、全く問題がなかったです。まさに新薬並みの臨床試験を要する医薬品の承認過程に沿って行ったという、そういう感想を持ちました。
黒川 物理化学的試験や薬理試験の結果が同じになったというデータを重ねることで、効果や安全性を担保するのがバイオシミラーの考え方です。たとえばリガンド(特定の受容体に特異的に結合する物質)としての性質やホルモンとしての性質が先行品と同じだということが薬理試験で確かめられれば、ヒトに対する薬理作用も同等だと推測できます。それを確認するために臨床試験が行われます。
●武藤 正樹(むとう まさき)
1978年新潟大学大学院医科研究科修了後、国立横浜病院(当時)にて外科医師として勤務。同院在籍中、ニューヨーク州立大学家庭医療学科に留学。国立医療・病院管理研究所医療政策研究部長、国立長野病院副院長等を経て、2006年より国際医療福祉大学三田病院副院長・国際医療福祉総合研究所長・同大学大学院教授。2013年4月より同大学大学院医療経営管理分野責任者。中央社会保険協議会(中医協)入院医療等の調査評価分科会会長、日本ジェネリック医薬品・バイオシミラー学会代表理事。
●黒川 達夫(くろかわ たつお)
1973年千葉大学薬学部卒業後、厚生省(当時)入省。薬務局 監視指導課等を経て、WHO職員。その後、科学技術庁、厚生省大臣官房国際課、医薬品審査、安全対策課長、大臣官房審議官等を歴任。2008年より千葉大学大学院薬学研究院特任教授、慶應義塾大学薬学部大学院薬学研究科教授。2016年より日本バイオシミラー協議会理事長。薬学博士。





